
Estàs llegint:

Estàs llegint:

16.05.24
10 minuts de lecturaEnvia les teves preguntes a:
Científic titular del CSIC i director del grup de Biologia Molecular de les Infeccions
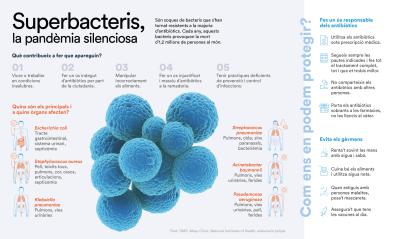
Sol·licitar entrevistaCada any al món 1,2 milions de persones moren per infeccions causades per bacteris resistents als antibiòtics. Segons l’OMS, la capacitat dels bacteris d’adaptar-se i resistir als fàrmacs dissenyats per combatre’ls ja és una de les amenaces més grans per a la salut pública mundial. Si no se’n frena l’augment, la resistència antimicrobiana podria provocar fins a 10 milions de morts al món el 2050. En quatre projectes de recerca subvencionats per les convocatòries CaixaResearch d’Investigació en Salut i CaixaImpulse d’Innovació en Salut del 2023 es busca afrontar aquest gran repte per a la humanitat amb abordatges molt diferents.
Quan Daniel López Serrano, bioquímic del Centro Nacional de Biotecnología del Consejo Superior de Investigaciones Científicas, va començar a fer ciència bàsica en un laboratori a principis dels anys 2000 i sol·licitava mostres als hospitals, es trobava amb un sol superbacteri entre les 20 mostres que rebia. Avui, el més normal és que les 20 mostres continguin bacteris resistents als antibiòtics. Per això, descobrir un nou antibiòtic eficaç és un gran repte per a la indústria farmacèutica. «La recerca pot durar dècades sense garanties que s’obtinguin resultats i la farmacoresistència apareix cada vegada més ràpidament, cosa que desincentiva la inversió en recerca i desenvolupament de nous antimicrobians», explica López Serrano.

El projecte que lidera aquest investigador té com a objectiu recuperar l’eficàcia dels antibiòtics que han deixat de funcionar per l’augment de bacteris resistents. El seu equip va descobrir el 2010 un procés cel·lular essencial per a la supervivència dels bacteris durant les infeccions. Ho explica així: «Aquest mecanisme s’encarrega d’estabilitzar i assemblar les maquinàries proteiques que té el bacteri, incloses les maquinàries responsables de la resistència als antibiòtics. Aquests anys, ens hem dedicat a entendre aquest mecanisme i hem pogut dissenyar tractaments que l’inhibeixen. Amb això, aconseguim que totes aquestes maquinàries no es puguin assemblar». En aquesta situació, l’administració dels antibiòtics clàssics funciona perquè els bacteris tenen els mecanismes de resistència desactivats.
Segons López Serrano, el gran avantatge d’aquest projecte, que ha rebut una subvenció de 494.300 euros de la convocatòria CaixaResearch d’Investigació en Salut 2023, és precisament que es proposa un tractament capaç de curar infeccions que no es podrien curar, i ho fa per mitjà de la reactivació d’antibiòtics comercialment disponibles.
«El que hem descobert no és una molècula, és un mecanisme; per la qual cosa el més directe per implementar-lo probablement serà desenvolupar-lo com a procés o teràpia hospitalària, més que comercialitzar-lo», argumenta l’investigador. «Fins ara, hem dissenyat el procediment per a un parell d’espècies bacterianes i intentarem expandir aquest coneixement a altres espècies, les més freqüents als hospitals, per crear un tractament que sigui universal».
Quan es desenvolupa un nou antibiòtic pot passar que, tot i que tingui capacitat d’atacar el bacteri, no aconsegueixi travessar-ne la membrana. Les estratègies actuals per facilitar aquest traspàs de la membrana no han aconseguit ser totalment eficaces. El projecte que lidera Javier Montenegro, químic del Centro Singular de Investigación en Química Biológica y Materiales Moleculares (CIQUS) de la Universidade de Santiago de Compostela, en col·laboració amb Mariana Pinho de la Universidade Nova de Lisboa, utilitza una nova aproximació per transportar els antibiòtics a l’interior dels bacteris que té molt potencial per habilitar l’ús d’antibiòtics ja existents en soques resistents o de permeabilitat limitada.

«Es tracta d’un repte molt complex, ja que no és fàcil travessar les membranes dels bacteris, sobretot les dels bacteris anomenats gramnegatius, que tenen una membrana externa que suposa una barrera addicional», explica Montenegro. Moltes vegades, les aproximacions actuals «utilitzen lípids per travessar membranes formades per altres lípids», cosa que requereix «l’encapsulació de les molècules, i això pot afectar tant la seva estabilitat com a l’alliberament de l’antibiòtic en el moment adequat», afegeix.
Tanmateix, l’equip de Montenegro i Pinho ha descobert una propietat dels clústers de bor que permet el pas de molècules hidròfiles —molècules que es dissolen a l’aigua— a través de membranes lipídiques. Per a Montenegro, aquesta gran fita científica, que ha rebut 984.050 euros de la convocatòria CaixaResearch d’Investigació en Salut 2023, suposa «un canvi complet de paradigma per a la ciència i l’entrega de fàrmacs. És una investigació molt innovadora i completament diferent del dogma establert. Ara necessitem entendre quines són les bases d’aquest mecanisme per poder-les aplicar al transport d’antibiòtics».
Tot i que els antibiòtics poden eliminar microorganismes, paradoxalment també contribueixen a l’aparició de bacteris resistents i en faciliten la proliferació en un entorn lliure de competidors. D’altra banda, avui en dia el desenvolupament d’antibiòtics experimenta un estancament.
Per aquest motiu, alguns projectes de recerca se centren a desenvolupar estratègies terapèutiques alternatives per desactivar la virulència dels superbacteris i resensibilitzar-los als antibiòtics, preservant al mateix temps la microbiota, la comunitat bacteriana natural del nostre organisme, que es pot veure alterada pels tractaments habituals amb antibiòtics. Aquest delicat ecosistema exerceix un rol essencial en la nostra salut intestinal, dermatològica i mental, i també en el nostre sistema immunològic, les nostres defenses contra els patògens, el nostre metabolisme i la regulació del nostre pes corporal.

L’equip de Didier Cabanes, biòleg molecular de l'Instituto de Investigação e Inovação em Saúde de la Universidade do Porto, estudia els bacteris grampositius, com els estafilococs, els estreptococs i Listeria. A la paret cel·lular de Listeria va descobrir que «alguns glicopolímers (sucres) presents a la seva superfície —que no eren determinants per al seu creixement— eren crucials no sols per a la resistència del bacteri a les defenses antimicrobianes de l’hoste i als antibiòtics, sinó també per a la patogenicitat bacteriana». Per aquest motiu, els investigadors creuen que «els enzims responsables de la presència d’aquests glicopolímers a la superfície bacteriana són dianes molt prometedores per als fàrmacs antimicrobians contra patògens grampositius».
El projecte, en col·laboració amb la Fundação para a Ciência e a Tecnologia (FCT), ha rebut una subvenció de 499.950 euros de la convocatòria CaixaResearch d’Investigació en Salut 2023. El seu objectiu final és desenvolupar fàrmacs antimicrobians de «nova generació» que, en inhibir els glicopolímers presents a la superfície dels superbacteris, en disminueixin la virulència, sense matar-los. Així, a poc a poc, es faran susceptibles a les defenses de l’hoste i s’aconseguirà potenciar l’acció dels antibiòtics, preservant la microbiota. «El nostre enfocament és el primer que desarmarà i sensibilitzarà simultàniament els patògens grampositius sense afectar-ne el creixement», conclou Cabanes.
A l’últim informe de l’agència European Centre for Disease Prevention and Control,el bacteri Klebsiella pneumoniae es trobava entre els tres principals causants d’infeccions resistents a antibiòtics. Concretament, el 2022 es van detectar més de 45.000 casos d’infecció per aquest bacteri a Europa, més d’un 15 % causats per soques immunes a l’efecte d’aquests fàrmacs. Aquesta és la raó perquè l’OMS ha classificat Klebsiella pneumoniae entre les espècies de preocupació crítica en l’àmbit sanitari, i perquè l’equip liderat per Mireia López Siles, microbiòloga de la Universitat de Girona, va decidir desenvolupar una vacuna per continuar lluitant contra aquest bacteri.
Klebsiella pneumoniae és un bacteri que es pot trobar en qualsevol ambient. En l’entorn hospitalari, s’acostuma a transmetre per contacte amb la pell, les mucoses, les femtes, les ferides o l’orina d’una persona infectada. La situació empitjora quan la soca que causa la infecció és, a més a més, resistent als antibiòtics. Disposar d’una vacuna podria augmentar la durada de la protecció enfront del bacteri en comparació amb el tractament antibiòtic, proporcionar immunitat de grup i reduir la mortalitat associada a aquestes infeccions. «Això és clau perquè permetria reduir tant l’ús d’antibiòtics per tractar infeccions com la probabilitat que apareguin més bacteris resistents als antibiòtics», explica López Siles.

El projecte, que ha rebut 50.000 euros de la convocatòria CaixaImpulse d’Innovació en Salut (finançament que es complementa amb l’acompanyament per part d’experts i mentors), es troba en fase preclínica. L’objectiu en aquesta fase és avaluar la capacitat de protecció in vivo de KlebsiGene, una vacuna d’ADN desenvolupada prèviament per la Universitat de Girona i l’Instituto de Salud Carlos III, i millorar-ne la formulació. Inclou dues innovacions principals, apunta la investigadora: «D’una banda, la vacuna es dirigeix a parts del bacteri que no han estat utilitzades prèviament en altres vacunes i que tenen un paper fonamental en la supervivència del bacteri, per la qual cosa esperem que aporti una millor protecció. D’altra banda, utilitzem una nova tecnologia d’ADN que incorpora elements per estimular la resposta immunitària del pacient».
Fins ara, l’equip que lidera López Siles ha desenvolupat vuit prototips de vacuna i ha comprovat que les cèl·lules humanes interpreten correctament la informació que li proporcionen aquestes vacunes. «També hem vist, per mitjà de predicció amb eines de bioinformàtica, que no tots els candidats vacunals funcionarien igual de bé per generar una resposta immunitària. Això ens ha permès prioritzar els prototips per fer proves d’eficàcia amb els més prometedors. Ara acabem de completar la fase de producció de dos d’aquests. El pas següent és demostrar en un organisme complex que la nostra vacuna és capaç d’activar el sistema immunitari i protegir davant la infecció.»
El desenvolupament d’aquesta vacuna «millorarà la qualitat de vida de les persones amb risc de patir una infecció per aquest microorganisme, especialment en l’àmbit hospitalari», afegeix la investigadora. I, a més, com que es tracta d’una vacuna d’ADN, és fàcilment adaptable a altres patògens, «ja que conté un fragment d’ADN específic que codifica per a l’antigen (la part que permetrà desenvolupar la resposta immunitària), que en el nostre cas és específic de Klebsiella pneumoniae. Canviant aquest fragment per un altre que codifiqui per un antigen de qualsevol altre microorganisme, obtindríem una vacuna dirigida a aquesta altra espècie. I també es podria dissenyar per prevenir infeccions per diversos patògens simultàniament, si s’hi inclouen seqüències d’antigen per a tots dos».
Aquest augment generalitzat dels superbacteris «és, en part, natural —els bacteris evolucionen i van adquirint resistència—», explica López Serrano, «però amb el nostre ús dels antibiòtics també hem contribuït a generar entorns, com els hospitals o la ramaderia (on s’han utilitzat els antibiòtics, de manera generalitzada, no solament per tractar infeccions bacterianes dels animals, sinó també per promoure’n el creixement, i també per prevenir malalties sense diagnòstic previ), que faciliten aquest procés evolutiu», fent que els antibiòtics deixin de ser efectius cada vegada més ràpidament.
Ja fa temps que les autoritats sanitàries treballen en estratègies per racionalitzar l’ús de fàrmacs antibiòtics, entre les quals hi ha la sensibilització de la ciutadania. Com ens recorda Didier Cabanes, els hem de fer servir «només sota prescripció mèdica i quan siguin realment necessaris». A més, «els tractaments s’han d’acabar», afegeix López Serrano, «i no s’han d’emmagatzemar per prendre’ls quan vulguem o donar-los als veïns. Una altra cosa important és el rebuig dels antibiòtics: si llencem els antibiòtics sobrants al vàter aquests acaben vessats al medi natural i els bacteris són allà també, així que és molt important dipositar-los en els punts de recollida habilitats a les farmàcies». El futur dels superbacteris també és a les nostres mans.
Per a saber més sobre els superbacteris, podeu veure el debat CaixaResearch sobre aquest tema: